محلول بافر و نقش آن در تنظیم pH (توضیح کامل)
- تعاریف شیمی, کاربردهای شیمی
- ۱۴۰۳/۱۱/۱۹

محلولهای بافر یکی از مهمترین ترکیبات شیمیایی در صنایع مختلف، آزمایشگاهها، پزشکی و بسیاری از فرآیندهای بیولوژیکی هستند. این محلولها نقش کلیدی در حفظ تعادل pH در سیستمهای شیمیایی و زیستی ایفا میکنند. در بسیاری از واکنشهای شیمیایی و زیستی، تغییرات شدید pH میتواند باعث اختلال در عملکرد طبیعی مواد شود، اما محلولهای بافر از این تغییرات جلوگیری کرده و محیطی پایدار ایجاد میکنند. در این مقاله، بررسی خواهیم کرد که محلول بافر چیست، چگونه عمل میکند، چه ترکیباتی دارد، چه انواعی از آن وجود دارد، چگونه تهیه میشود و چه مزایا و معایبی دارد.
بافر چیست؟
بافر به ترکیباتی گفته میشود که میتوانند در برابر تغییرات pH مقاومت کنند و از تغییر ناگهانی مقدار pH در یک محیط جلوگیری کنند. به بیان ساده، اگر به یک محیط بافر شده مقدار کمی اسید یا باز اضافه شود، pH آن تغییر محسوسی نمیکند.
محلول بافر چیست؟
محلولهایی که بر اثر افزایش اسید یا باز، مقاوم بوده و دچار تغییر محسوس PH نمیشوند یا به عبارتی اسید یا باز اضافه شده را خنثی میکنند را محلول بافر میگویند.
محلول بافر ترکیبی از یک اسید ضعیف و نمک آن یا یک باز ضعیف و نمک آن است که میتواند pH محیط را در یک محدوده خاص حفظ کند. این محلولها در سیستمهای بیولوژیکی مانند خون، در فرایندهای صنعتی مانند تولید مواد شیمیایی و در آزمایشگاههای تحقیقاتی برای تنظیم شرایط واکنشهای شیمیایی مورد استفاده قرار میگیرند.

محلول بافر شامل چه ترکیباتی است؟
محلولهای بافر به طور کلی شامل ترکیبات زیر هستند:
• یک اسید ضعیف (HA) و نمک آن (-A) (مانند اسید استیک و استات سدیم) یا یک باز ضعیف (B) و نمک آن (+HB) (مانند آمونیاک و کلرید آمونیوم)
• حلال (معمولاً آب)
البته ترکیب دقیق محلول بافر بستگی به نوع بافر و کاربرد آن دارد.
برای اطلاع از قیمت و سفارش محلول بافر مورد نظر خود، کلیک کنید:
عملکرد محلول بافر چگونه است؟
محلولهای بافر براساس تعادل شیمیایی و معادله هندرسون-هاسلباخ کار میکنند. اگر یک اسید یا باز قوی به محلول بافر اضافه شود، تعادل به سمت واکنش با آن تغییر کرده و از تغییر pH جلوگیری میشود.
به عنوان مثال اگر محلولی از اتانوئیک اسید (اسید ضعیف) و آب درست کنیم، واکنش تعادلی زیر ایجاد میشود:
CH3COOH + H20 ⇋ (CH3COO–) + (H3O+)
حال اگر به این محلول نمک خود اسید ضعیف یعنی استات سدیم را اضافه کنیم، یک واکنش دیگر نیز داریم:
NaCH3COO→(CH3COO–) + (Na+)
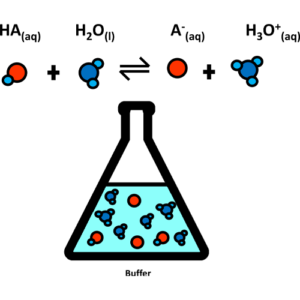
حالا در این محلول به یون (–CH3COO) یون مشترک میگویند که اساس کار بافرهاست.
با توجه به این واکنش ها و محلولی که درست شده محلول بافر ما آماده است. اما این محلول چگونه PH را تنظیم میکند؟
۱- حالت اول:
اگر به این محلول مقداری اسید اضافه کنیم، به دلیل اینکه اسید یون (+H30) تولید میکند، در سمت راست واکنش اول میزان یون (+H30) زیاد میشود اما به دلیل اینکه واکنش ما تعادلی هست و واکنش میخواهد تعادل را حفظ کند واکنش از یون (+H30) دور میشود (به سمت چپ میرود) تا تعادل برقرا بشه و (+H30) اضافی از بین بره و به اسید CH3COOH تبدیل بشه. البته در نظر داشته باشید زمانی که واکنش به سمت چپ یعنی به سمت مصرف یون های (+H30) و (–CH3COO) در واکنش اول میره تعادل به دلیل مصرف یون (–CH3COO) بهم نمیخوره زیرا یون مشترک در واکنش دوم تعادل این یون رو برقرا میکند.
۲- حالت دوم:
اگر به این محلول مقداری باز اضافه کنیم، به دلیل اینکه باز یون (–OH) تولید میکنه، در سمت راست واکنش اول یون (–OH) و (+H30) باهم واکنش میدهند و از افزایش PH جلوگیری میشود.
در این حالت برای اینکه کمبود یون (+H30) به دلیل واکنشش با یون (–OH) جبران بشه، واکنش کمی به سمت راست میآید تا تعادل برگردد ( البته زیاد نمیتونه به این سمت بیاد چون میزان یون مشترک بیش از اندازه میشود و خود یون مشترک اجازه این کار را نمیدهد).

معادله هندرسون-هاسلباخ
برای محاسبه pH یک محلول بافر از معادله هندرسون-هاسلباخ استفاده میشود:
pH = pKa + log([A−]/[HA])
که در آن:
pKa: ثابت تفکیک اسیدی است.
[-A]: غلظت نمک اسید است.
[HA]: غلظت اسید است.
این معادله نشان میدهد که نسبت غلظت اسید و باز تعیینکننده pH نهایی محلول بافر است (یا میتوان گفت با تغییر نسبت نمک اسید ضعیف به اسید ضعیف، pH محلول بافر نیز تغییر میکند، اما این تغییر معمولاً باعث تغییر محسوس PH نمیشود).
انواع محلولهای بافر + ویژگی و کاربردهایشان
محلولهای بافر براساس ترکیبات شیمیایی و کاربردهایشان به چند دسته تقسیم میشوند:
۱- بافرهای اسیدی:
• شامل یک اسید ضعیف و نمک آن (باز مزدوج) هستند.
• توانایی حفظ pH در محدوده اسیدی را دارند.
مثال: بافر استات (اسید استیک + استات سدیم)
این بافر در pH حدود ۴ تا ۶ کارایی بهینه ای دارد.
کاربرد: در فرایندهای بیوشیمیایی و صنعتی که نیاز به محیط اسیدی دارند و همچنین در صنایع غذایی و در سیستمهای بیولوژیکی مانند سلولها کاربرد دارد.
برای اطلاع از قیمت و سفارش محلول بافر PH=4، کلیک کنید:
۲- بافرهای بازی:
• شامل یک باز ضعیف و نمک آن(اسید مزدوج) هستند.
• توانایی حفظ pH در محدوده بازی را دارند.
مثال: بافر آمونیاک (آمونیاک + کلرید آمونیوم)
این بافر در pH حدود ۹ تا ۱۱ کارایی بهینه ای دارد.
کاربرد: در صنایع داروسازی، بیوشیمیایی، شویندهها و تولید کود.
۳- بافرهای بیولوژیکی:
• سیستمهای زندهای هستند که در سیستمهای زیستی مانند خون و سلولها یافت میشوند.
• توانایی حفظ pH در محدودههای دقیق.
مثال: بافر بیکربنات خون (HCO₃⁻/CO₂)
این بافر میتواند pH را محدوده ۷٫۳۵ تا ۷٫۴۵ نگه دارد.
کاربرد: از تغییرات ناگهانی pH جلوگیری میکند. اگر این سیستم مختل شود منجر به مشکلات سلامتی میشود.
۴. بافرهای صنعتی و آزمایشگاهی:
• در فرایندهای شیمیایی و تحقیقاتی استفاده میشوند.
مثال: بافر تریس (Tris buffer)
این بافر در pH حدود ۷ تا ۹ کارایی بهینه ای دارد.
کاربرد: در بیوشیمی، زیستفناوری و واکنشهای آنزیمی و فرآیندهای کشت سلولی.
۵- بافرهای ترکیبی:
• بافرهای ترکیبی شامل ترکیب دو یا چند محلول بافر مختلف هستند که بهصورت همزمان برای تنظیم pH در یک محدوده خاص و پایدارسازی واکنشهای شیمیایی استفاده میشوند.
• این محلولها معمولاً در سیستمهایی که نوسانات زیادی در pH دارند یا به یک دامنه وسیعتری از pH نیاز دارند، به کار میروند.
• این نوع بافرها پایداری بیشتر در برابر تغییرات شدید محیطی دارند.
مثال ۱: بافر فسفات-سیترات
این بافر در pH حدود ۳ تا ۸ کارایی بهینه ای دارد.
مثال ۲: بافر تریس-گلیسین
این بافر در pH حدود ۸.۳ تا ۹.۵ کارایی بهینه ای دارد.
مثال ۳: بافر بورات-فسفات
تنظیم دقیق pH در یک محدوده وسیع.
کاربرد: در محیطهای آزمایشگاهی پیچیده، صنایع غذایی، دارویی، محیطهای بیولوژیکی، محلولهای الکترولیت و الکتروفورز پروتئینها
۶- بافرهای تخصصی:
• بافرهای تخصصی برای کاربردهای خاص و حساس که نیاز به تنظیم دقیق pH و ویژگیهای شیمیایی ویژه دارند، طراحی میشوند.
• این بافرهای دارای ترکیبات خاص هستند که برای سازگاری با مواد شیمیایی و زیستی حساس به کار میروند.
• مقاومت بالا در برابر عوامل مزاحم مثل تغییرات دما و فشار.
مثال: بافر HEPES
برای حفظ pH در محدوده ۶.۸ تا ۸.۲ استفاده میشود.
کاربرد: در محیطهای کشت سلولی و آزمایشهای بیوشیمیایی.

چگونگی انتخاب محلول بافر مناسب
• محدوده pH موردنظر (بافر باید pH مطلوب موردنیاز ما را حفظ کند)
• سازگاری شیمیایی: بافر نباید در واکنشهای شیمیایی مانعی ایجاد کند و با مواد دیگر واکنش دهد.
• دمای عملکرد (برخی محلولهای بافر در دماهای خاص بهتر عمل میکنند)
• فاقد ایجاد مشکل: در برخی از سیستم های حساس نباید از بافری که ایجاد مشکل میکند استفاده کرد.
مثال: در سیستمهای بیولوژیکی، بافر نباید به سلولها آسیب برساند.
ظرفیت بافر چیست؟
به حداکثر میزان باز یا اسیدی که میتوان تا پیش از تغییر شدید در PH به یک محلول بافر اضافه کرد، ظرفیت بافر میگویند.
• این نکته هم باید دانست که هیچ بافری ظرفیت نامحدود ندارد.
• ظرفیت بافر به غلظت اجزای بافر و نسبت غلظت اسید و باز مزدوج بستگی دارد.
محلول بافر چگونه تهیه میشود؟
۱- انتخاب ترکیب مناسب (اسید و نمک آن یا باز و نمک آن)
۲- محاسبه نسبت مناسب اجزا (بر اساس معادله هندرسون-هاسلباخ)
۳- حل کردن ترکیبات در آب
۴- تنظیم pH نهایی (در صورت نیاز با افزودن اسید یا باز)
۵- ذخیره محلول در ظروف مناسب و در دمای پایدار

مزایا و معایب محلولهای بافر
مزایا:
۱- پایداری pH در واکنشها
۲- جلوگیری از تخریب مواد حساس به pH
۳- کاربرد گسترده در صنایع مختلف
۴- افزایش دقت در آزمایشهای شیمیایی و بیولوژیکی
معایب:
۱- ظرفیت بافر محدود است.
۲- برخی محلولهای بافر ناپایدار بوده و نیاز به تنظیم دورهای دارند.
۳- در برخی موارد، ترکیبات آن ممکن است سمی باشند.
۴- استفاده نادرست از آنها ممکن است باعث تغییر در ترکیبات شیمیایی شود.
۵- محدودیت در محدوده pH (نمیتوان از یک نوع بافر برای کنترل pH در تمامی محدودهها استفاده کرد.)
نکات ایمنی و نحوه نگهداری
• در هنگام کار با محلولهای بافر، از دستکش و عینک ایمنی استفاده کنید.
• برخی محلولهای بافر حاوی مواد شیمیایی خطرناک هستند و باید در محیط تهویهشده استفاده شوند.
• در صورت تماس با پوست یا چشم، محل آلوده را با آب بشویید و در صورت نیاز به پزشک مراجعه کنید.
• محلولهای بافر باید در ظروف دربسته و به دور از نور و حرارت نگهداری شوند.
جمعبندی
محلولهای بافر ترکیباتی حیاتی برای حفظ تعادل pH در سیستمهای مختلف هستند. این محلولها بر اساس ترکیبات شیمیایی خود به انواع مختلفی تقسیم میشوند و در صنایع مختلف از آزمایشگاههای بیوشیمی گرفته تا فرایندهای صنعتی کاربرد دارند. با توجه به ویژگیهای محلولهای بافر، انتخاب نوع مناسب آن برای هر کاربرد خاص ضروری است.
برای بازدید از فروشگاه و سفارش انواع محلولهای بافر و سایر محصولات شیمیایی، کلیک کنید:





